|
近日,我组改造真菌脂肪酸合酶研究取得重要进展。我们与瑞典查尔姆斯理工大学(Chalmers University of Technology)Jens Nielsen教授和德国法兰克福大学(Goethe University Frankfurt)Martin Grininger教授合作,设计改造脂肪酸合酶,扩展了脂肪酸合成机器的产物谱,相关研究成果在Nature Chemical Biology在线发表(doi:10.1038/nchembio.2301),论文拟在该刊四月期以封面故事的形式正式发表。 脂肪酸是组成细胞的重要分子,也是生物燃料和油脂化工的基础原料。脂肪酸合酶(FAS)是细胞合成脂肪酸的关键酶。真菌FAS是多功能酶,含7个不同催化结构域(AT,ER,DH,MPT,KR,KS和PPT)和1个酰基载体蛋白(ACP)结构域,分子量约270万道尔顿。真菌FAS组装成笼型结构,被赤道面隔成两个空腔,各催化活性中心分布于空腔内壁;ACP被柔性肽链拴住,位于空腔中心,可有序移动并将携带的脂酰基送到各活性中心进行反应。鉴于真菌FAS复杂和结构刚性的特征,过去认为很难操纵和改造。 前期采用多组学策略研究产油酵母积累脂肪酸甘油脂的分子机制中发现,圆红冬孢酵母携带一种含双ACP结构域、基因结构特殊的FAS(Nat. Commun. 2012, 3, 1112)。冷冻电镜分析表明,该FAS也组装成典型笼型结构(Protein Sci. 2015, 24, 987)。本研究的体外生物化学实验及酿酒酵母基因功能回补实验发现,去掉该FAS其中任何一个ACP结构域仍可保持正常的脂肪酸合成功能,暗示圆红冬孢酵母FAS的ACP功能有冗余性。基于此,研究人员利用细菌来源的硫酯酶(TE)替换其中一个ACP,成功构建了系列杂合FAS,并以酿酒酵母为宿主进行功能测试,发现可获得过量产生短/中等链长脂肪酸的能力;类似地,利用甲基酮合酶(Mks2)替换一个ACP,获得长链甲基酮合成的新功能。更重要的是,采用该策略改造其它真菌来源的FAS,所得杂合FAS也表现出预期的生物功能。该研究表明,异源蛋白可嵌入真菌FAS的空腔,得到具有新功能的脂肪酸合成机器,为合理借用脂肪酸代谢途径进行生物制造提供了新机遇。 研究工作得到国家自然科学基金委资助 (21325627),并得到生物分离分析新材料与新技术研究组(1809组)和公共分析测试组协助。 论文第一作者为我组朱志伟,2014年博士毕业,目前在查尔姆斯理工大学从事博士后研究,合作导师Nielsen教授为我所张大煜讲座教授。(文/图 朱志伟) 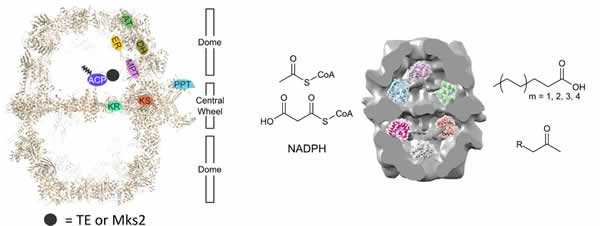
|





